電泳是鑒定和分離大分子的常用實驗室程序。它是由莫斯科的一位大學科學家于1800年代初首次觀察到的。像許多發(fā)現(xiàn)一樣,這是偶然的,但事實證明它對許多研究場景都有用。通過施加電流,技術人員可以使用顆粒的負電荷或正電荷,使它們遷移穿過瓊脂糖凝膠等多孔基質。當樣品中存在帶正電的分子時,它們將向負電流(陰極)蠕變,而帶負電的分子將向正電流(陽極)遷移。
除了電源和凝膠外,該動力學測試還需要緩沖液以幫助防止溫度和pH值過高。所用凝膠的類型取決于樣品和應用。凝膠是“固體”,但多孔。在凝膠內,較大的分子將更慢地移動,而較小的分子將快速移動。因此,分子大小是分離樣品和鑒定分子的另一種方法。
那么,既然我們了解了電泳的動力學,我們如何看待這些粒子在何處移動?這些分子可能是“宏觀”的,但它們仍然太小而無法用肉眼觀察。我們實驗的最后一個必需成分是污點。一組染料使我們可以直觀地看到顆粒所經(jīng)過的路徑。從那里,我們可以捕獲圖像以記錄結果。
存在幾種在凝膠電泳過程中對核酸染色的選擇。溴化乙錠(EtBr)是最著名和最常用的DNA染料。它是一種結合DNA的嵌入劑,當暴露于紫外線下時其熒光增加20倍。EtBr是最便宜的DNA染色劑,是許多研究實驗室的理想選擇。但是,EtBr必須小心使用,因為它是已知的誘變劑。另外,EtBr要求暴露在紫外線下才能看到,但是會發(fā)生分子損傷。當將DNA用于下游應用如克隆時,這就提出了一個問題。
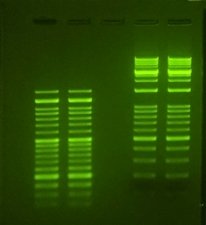
核酸染色,通過紫外線觀察。
已經(jīng)開發(fā)出替代的DNA染料,例如SYBR Safe,它們不具有與EtBR相同的誘變特性。SYBR Safe不被認為是危險的,可以使用實驗室的常規(guī)污水處理系統(tǒng)進行處理。此外,它在藍光下發(fā)出熒光,從而防止了使用紫外線時發(fā)生的DNA損傷。
已顯示許多DNA染色劑可抑制聚合酶鏈反應(PCR)。當需要高PCR效率(例如實時定量PCR)時,可行的DNA染料應為Eva Green。與其他常見的電泳染料相比,它在較小程度上限制了PCR。Eva Green還比EtBr等傳統(tǒng)污漬更安全。
與DNA凝膠類似,蛋白質凝膠染色有多種選擇。兩種最常見的污漬是考馬斯亮藍和銀染。考馬斯是一種陰離子染料,可與蛋白質非特異性結合。一旦去除多余的污漬,蛋白質條帶將顯示為藍色條帶。考馬斯染色由于其易用性和可承受的成本而成為最普遍的蛋白質染色方法。
相反,銀染色比考馬斯亮靈敏,可以檢測相對少量的蛋白質。但是,靈敏度是有代價的,因為銀染劑還可以與多糖和核酸結合,從而在銀染的凝膠上產(chǎn)生雜散帶。
電泳凝膠和緩沖溶液中的化學物質也會影響染料的性能,因此您的家庭作業(yè)也是如此。根據(jù)您實驗室中的樣品,應用和記錄的測試結果,選擇具有最高潛力的良好測試結果。使用有關樣品和試劑制備,染料量,膠凝時間和溫度,脫色,存儲和其他關鍵任務的最佳實踐。最后,記住你的手套!