一、 試驗(yàn)?zāi)康?
1. 學(xué)會(huì)溶膠制備的基本原理,并掌握溶膠制備的主要方法。 2. 利用界面電泳法測(cè)定AgI溶膠的電動(dòng)電位。
二、試驗(yàn)原理
溶膠是溶解度極小的固體在液體中高度分散所形成的膠態(tài)體系,其顆粒直徑變動(dòng)在9-7-10-10范圍。
1.溶膠制備
要制備出穩(wěn)定的溶膠一般要滿足兩個(gè)條件:固體分散相的質(zhì)點(diǎn)大小必須在膠體分度的范圍;固體分散質(zhì)點(diǎn)在溶液介質(zhì)中要保持不聚結(jié),為此,一般需要加穩(wěn)定劑。
制備溶膠原則上有兩種方法:將大塊固體分割到膠體分散度的大小,此法稱為分分散法;使小分子或粒子聚集成膠體大小,此法稱為凝聚法。
(1) 分散
(2) 分散法主要有3種方式,即機(jī)械研磨、超聲分散和溶膠分散。
①研磨法:常用的設(shè)備主要有膠體磨和球磨機(jī)等。膠體磨由兩片靠得很近的盤或磨刀,均由堅(jiān)硬耐磨的合金或碳化硅制成。當(dāng)上下兩磨盤以高速反向轉(zhuǎn)動(dòng)時(shí),粗粒子就被磨細(xì)。
②超聲分散法:頻率高于16000Hz的聲波稱為超聲波,高頻率的超聲波傳入介質(zhì),在介質(zhì)中產(chǎn)生相同頻率的疏密交替,對(duì)分散相產(chǎn)生很大的撕碎力,從而達(dá)到分散效果。
③膠溶法:膠溶法是把暫時(shí)聚集在一起的膠體粒子重新分散而成溶膠。 (2)凝聚法
主要有化學(xué)反應(yīng)法及更換介質(zhì)法,此法的基本原則是形成分子分散的過飽和溶液,控制條件,使形成的不溶物顆粒大小在溶膠分散度內(nèi)。此法與分散度相比不僅在能量上有限,而且可以制成高分散度的膠體。
①化學(xué)反應(yīng)法:凡能形成不溶物的復(fù)分解反應(yīng),水化反應(yīng)以及氧化還原反應(yīng)等皆可用來制備溶膠。由于離子的濃度對(duì)膠體的穩(wěn)定性有直接的影響,在制備溶膠時(shí)要注意控制電解質(zhì)的濃度。
②改換介質(zhì)法:此法系利用同一物質(zhì)在不同溶劑中溶解度相差懸殊的特性,使溶解于良溶劑中的溶質(zhì),在加入不良溶劑后,因其溶解度下降而以膠體粒子的大小析出,形成溶膠。此法作溶膠方法簡(jiǎn)便,但得到的溶膠粒子不太細(xì)。
2. 溶膠的電泳 在電場(chǎng)的作用下,膠體粒子向正極或負(fù)極移動(dòng)的現(xiàn)象叫電泳。電泳現(xiàn)象粒子的帶電性。膠體粒子帶電是因?yàn)樵谄渲車纬闪藬U(kuò)散雙電層。按對(duì)固體的關(guān)系,擴(kuò)散雙電層離子可沿滑動(dòng)面分為吸附層離子和擴(kuò)散層離子兩部分,使固體表面和

三、儀器與藥品
1.儀器
電泳儀,電導(dǎo)率儀,電爐,秒表,電極2支,100mL燒杯2個(gè),50mL、150mL、250mL 、500mL、燒杯各1個(gè),滴定管2個(gè),滴管1個(gè),10mL量筒2個(gè),250mL量筒1個(gè),100mL、500mL錐形瓶各2個(gè),試管2支,漏斗2個(gè),洗瓶1個(gè)。
1.藥品
20%FeCl3,3%FeCl3, 0.02mol/L AgNO3, 0.02mol/L KI, 0.1mol/LAgNO3, 10%NH3,水,0.01mol/L KCl, 2%松香乙醇溶液,火棉膠。
四、實(shí)驗(yàn)步驟
(一)溶膠的制備 1. 膠溶法
氫氧化鐵溶膠的制備:取10毫升20%氯化鐵放在小燒杯中,加水稀釋到100毫升然后用滴管逐滴加入10%氨水到稍微過量為止。過濾生成的氫氧化鐵沉淀,用蒸餾水洗滌數(shù)次。將沉淀放入一燒杯中,加10毫升蒸餾水,再用滴管滴加約10滴20%氯化鐵溶液,并用小火加熱,**后得到棕紅色透明的氫氧化鐵溶膠。 2. 改換介質(zhì)法
松香溶膠的制備:配制2%的松香乙醇溶液,用滴管將溶液逐滴滴入到盛有蒸餾水的燒杯中,同時(shí)劇烈攪拌,可得到半透明的溶膠。如果發(fā)現(xiàn)有較大的質(zhì)點(diǎn),需將溶膠再過濾一次。 3.化學(xué)反應(yīng)法
(1)氫氧化鐵的溶膠制備:再一個(gè)250mL的燒杯中加入150mL蒸餾水并加熱**沸騰,在不斷攪拌下滴加8毫升3%的氯化鐵溶液,溶液變成暗棕紅色的氫氧化鐵膠體。然后對(duì)此溶膠進(jìn)行滲析,除去多余的電解質(zhì)。滲析的方法是按下列步驟先做一個(gè)滲析用的火棉膠袋:將一個(gè)500毫升的錐形瓶洗凈烘干,將火棉膠液倒入錐形瓶中,傾斜錐形瓶并慢慢的移動(dòng),使錐形瓶?jī)?nèi)均勻地涂上一層膠液,然后倒出火棉膠。當(dāng)火棉膠干后,將瓶口的膠膜剝離開一小部分。從此剝離口慢慢的加入蒸餾水,膠帶逐漸與瓶壁剝離,取出膠袋,再蒸餾水中浸泡數(shù)小時(shí)。
將上面制備的氫氧化鐵溶膠倒入火棉膠袋,并懸掛在盛有蒸餾水的大燒杯中,每小時(shí)換一次蒸餾水,直到用0.1mol/L硝酸銀溶液檢驗(yàn)無氯滲析便可結(jié)束。
(2)碘化銀溶膠的制備:在兩個(gè)錐形瓶中分別準(zhǔn)確的加入5mL0.02mol/L KI和0.02mol/L硝酸銀溶液,在盛有KI溶液的瓶中在攪拌下再準(zhǔn)確地滴加4.5mL0.02mol/L硝酸銀溶液。在另一盛有硝酸銀溶液的瓶中再準(zhǔn)確的滴加4.5ml0.02mol/L KI溶液。觀察兩錐形瓶中AgI溶膠透射光及散射光顏色。
(二)AgI 溶膠的電泳 1. AgI負(fù)溶膠的制備
在400ml的燒杯中加入100ml0.01mol/L的K溶液,攪拌下用滴定管加入95ml0.01mol/L的AgNO3溶液即制的AgI負(fù)溶膠 2. 輔助液的制備 3. 電勢(shì)的測(cè)定 仔細(xì)洗凈電泳管,檢查活塞是否潤(rùn)滑良好且不漏。用少量配好的AgI溶膠將電泳管的漏斗**活塞支管洗一遍。用滴管由漏斗加入少量溶膠,使活塞孔內(nèi)充滿溶膠,迅速關(guān)閉活塞。用輔助液洗滌U形管部分。活塞以上若有溶膠也應(yīng)洗去。將電泳管垂直固定在鐵支架上。沿U形管加入輔助液,直到頁(yè)面超過管**底刻度線3-4cm。從漏斗加入溶膠,慢慢開活塞(不要全部打開,一定要慢,否則得不到清晰的溶膠界面)。使溶膠慢慢上升。當(dāng)輔助液離管口5-6cm處,輕輕插入兩個(gè)電極,裝好。當(dāng)輔助液將電極浸沒1cm時(shí),停止加溶膠,關(guān)閉活塞。整個(gè)過程注意保持平衡,不使電泳管受振動(dòng)。 將
電泳儀電源開關(guān)扳下,將輸出調(diào)節(jié)旋鈕反時(shí)針方向旋**輸出電壓**小位置,接好電源線,做好開機(jī)準(zhǔn)備。將兩電極引線接在
電泳儀上,將電泳儀電源開關(guān)扳上,指示燈亮,預(yù)熱5分鐘后調(diào)節(jié)電壓為200V。觀察溶膠上升界面清晰后,用秒表界面上升0.5、1.0、1.5cm所需時(shí)間。測(cè)量完畢,先將輸出調(diào)節(jié)旋鈕旋**輸出電壓**小位置,扳下電源開關(guān),指示燈滅,扳下電極引線。用直尺測(cè)量出兩電極之間的距離。實(shí)驗(yàn)結(jié)束后,洗凈使用過的所有玻璃儀器。 #p#分頁(yè)標(biāo)題#e#
五、數(shù)據(jù)處理
1.總結(jié)溶膠的制備方法
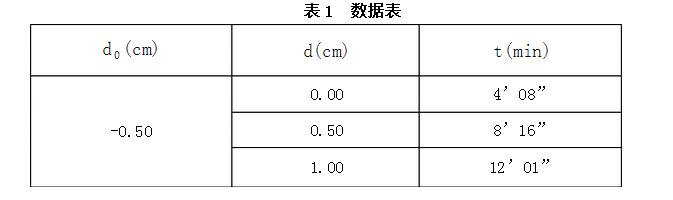
答:有膠溶法、改換介質(zhì)法和化學(xué)反應(yīng)法。 2.計(jì)算AgI負(fù)溶膠的電勢(shì),并取平均值。
電壓V=200V;室溫T=19℃;L=7.80cm

六、思考題
1、比較不同溶膠的制備方法有什么共同點(diǎn)和不同點(diǎn)。
答:共同點(diǎn)是均要把固體顆粒直徑控制在膠體粒子大小,不同點(diǎn)是實(shí)現(xiàn)這一結(jié)果的過程不同,有膠溶法、改換介質(zhì)法和化學(xué)方法。 2、為什么要求輔助液與溶膠的電導(dǎo)率相同?這對(duì)計(jì)算電動(dòng)電勢(shì)有什么作用。 答:因?yàn)樵跍y(cè)電勢(shì)時(shí),電勢(shì)對(duì)輔助液的成分敏感,只有控制輔助液的電導(dǎo)率與待測(cè)溶膠的電導(dǎo)率相等才能保證輔助液的移動(dòng)速度與溶膠相等,可以避免因界面處電場(chǎng)強(qiáng)度突變?cè)斐蓛杀诮缑嬉苿?dòng)速度不等產(chǎn)生的界面模糊。這樣能使計(jì)算電動(dòng)勢(shì)更加方便簡(jiǎn)單。
3、注意觀察,電泳時(shí)溶膠上升界面與下降界面的顏色、清晰程度及移動(dòng)速度有什么不同。分析產(chǎn)生這些差別的可能原因。
答:上升界面顏色較深,較清晰,移動(dòng)速度較慢,下降界面顏色較淺,不太清晰,顏色較淺,移動(dòng)速度較快。因?yàn)殡娪鹃_始后,帶負(fù)電的AgI粒子向正極移動(dòng),而移動(dòng)速度**快的離子走在**前面,其他離子依電極速度快慢順序排列,上升界面一下只有AgI,而下降界面還有cl-,其移動(dòng)速度比AgI粒子快,使下降界面顏色變淡,移動(dòng)速度變快,不太清晰。


