實驗原理
根據蛋白分子量亞基的不同而分離蛋白,在樣品介質和丙烯酰胺凝膠中加入離子去污劑和強還原劑后,蛋白質亞基的電泳遷移速率主要取決于亞基分子量的大小。 實驗所用儀器
FR-200A全自動紫外與可見分析裝置 上海復日科技有限公司
電泳儀 BIO-RAD公司
TS-1型
脫色搖床 江蘇海門市其林貝爾儀器制造有限公司 實驗用試劑
低分子量蛋白Maker TAKARA 4*上樣緩沖 TAKARA
Pagn Blue protein staining solution Fermentas 試劑的配制 1. 貯液的配制 (1) 凝膠儲液
取30g丙烯酰胺+0.8g甲叉雙丙烯酰胺0.8g ,先用35ml雙蒸水溶解,攪拌,直到溶液變成透明,再用雙蒸水稀釋**100ml,過濾。棕色瓶4℃保存一個月。 (2)1 mol/l Tris-HCL (PH 8.8)
12.1g Tris(三羥甲基氨基甲烷)溶解在80ml雙蒸水中,用4mol/l鹽酸調PH**8.8。再用雙蒸水稀釋**100ml,保存在4℃冰箱。 (3)1.0 mol/l Tris-HCL (PH 6.8)
6.06g Tris溶解在40ml雙蒸水中,用用4mol/l鹽酸調PH**6.8。再用雙蒸水稀釋**50ml,保存在4℃冰箱。 (4)10%過硫酸銨(APS)
0.1g過硫酸銨+1ml雙蒸水。使用前新鮮配制(5)Tris–甘氨酸電泳緩沖液的配制(25mmol/L Tris;250mmol/L甘氨酸(pH8.3))
30.3gTris+ 144.2g甘氨酸+ 10gSDS,雙蒸水定容**1L。 每次使用時10倍稀釋。 (6) 樣品緩沖液
使用4*SDS-PAGE loading buffer(Takara公司),上樣緩沖與樣品比例1:3混勻,之后煮沸5min。 2. 凝膠的配制
具體步驟如下:
1、樣品制備:40 µL蛋白+5*上樣緩沖液10 µL,煮沸5 min,冷卻后放冰箱下層保存,備用
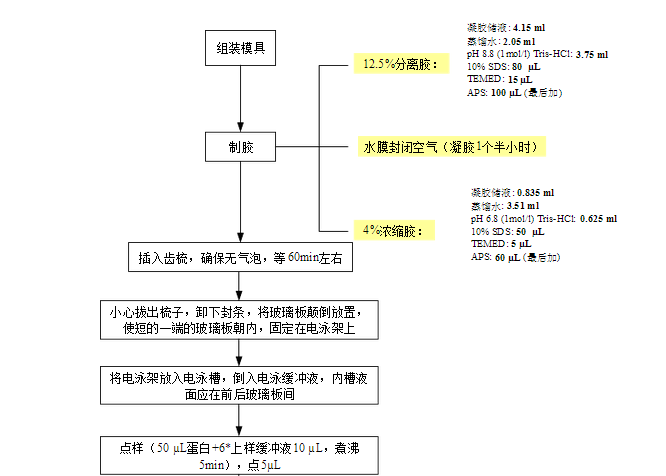
2、制膠
1) 用專用的醫用棉口罩將膠板擦拭干凈,
電泳槽清洗干凈,組裝模具。
注:必須使用專用的棉口罩擦拭膠板,且輕輕的向一個方向擦拭,以免劃壞膠板。
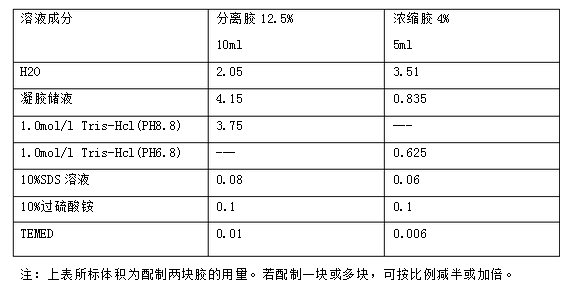
2) 按上表成分配制分離膠,迅速搖勻,沿膠的一邊,迅速灌入分離膠,注意勿打入氣泡,
迅速水封。 3) 放置1.5h。
4) 傾去蒸餾水,用濾紙將未倒干凈的水吸干。
5) 按上表成分配制濃縮膠,迅速搖勻,沿膠的一邊,迅速灌入濃縮膠,注意勿打入氣泡,
迅速插入齒梳。 6) 放置1h。 注:新配置的凝膠,室溫放置5h,使膠充分凝聚、混勻,之后再使用,效果更好。忌馬上電泳。
3、配制電泳緩沖及上樣
取配好的10*電泳緩沖130ml,用蒸餾水稀釋**1300ml。
將制好的凝膠用電泳夾固定**
電泳槽中。注:短板朝里。若只跑一塊膠,電泳夾的對面也必須放置一塊電泳板。
倒入電泳緩沖液,液面**短板和長板之間。 每孔上樣量**大20ul。蛋白Maker上樣量7ul。
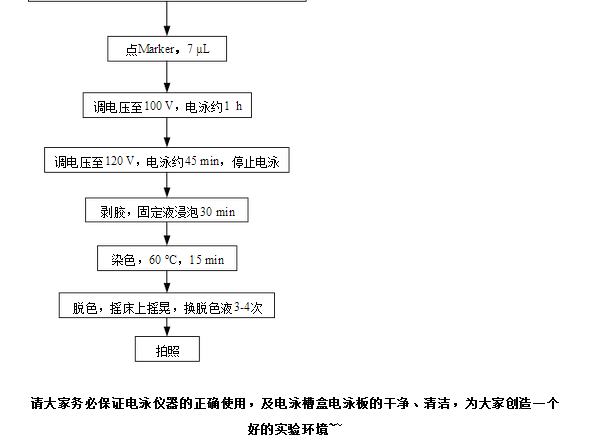
4、 電泳
80V 45min;120V 45min。
注:若120v 45min后,溴酚藍指示劑前沿距離電泳板下端太遠,可延長電泳時間,或適當增加電壓,待跑**距電泳板下端1cm時停止電泳。 5、 剝膠
剝膠過程必須浸在蒸餾水中進行。 6、 水洗
電泳結束后,用蒸餾水洗膠三次,每次10min。 7、 染色
將膠**于
脫色搖床上,使用考馬斯亮藍染色液(fermentas公司)過夜染色。 注:考馬斯亮藍染色液的使用,請嚴格按照染色液說明上的操作步驟進行。
考馬斯亮藍染液可重復利用3次,使用一次的染液請倒回使用一次的回收瓶中,使用過兩次的染色液倒回使用兩次的回收瓶中,用滿三次才可廢棄。 8、 水洗
蒸餾水洗1-2小時,洗去背景色。拍照。 9、 清洗膠板和電泳槽。
注:清洗和擦拭膠板時,請使用專用的醫用棉口罩清洗,用水沖洗時,輕輕擦拭,將殘留的膠清洗干凈,注意不要太用力,以免劃壞膠板。洗好后,放置專用的膠架上晾干,晾干后放入相應的膠盒中。 10、
清理實驗臺,將實驗儀器擺放整齊。