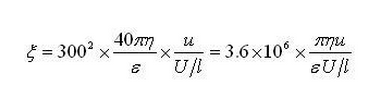一、實驗目的
1.掌握電泳法測定ξ電勢的原理與技術;
2.加深理解電泳是膠體中液相和固相在外電場作用下相對移動而產生的電性現象。 3.觀察膠體的電泳現象,了解宏觀電泳法測ζ電勢的技術; 4.掌握測定膠粒的運動速度和電荷符號的方法。
二、實驗原理
膠體溶液是一個多相體系,分散相膠粒和分散介質帶有數量相等而符號相反的電荷,因此在相界面上建立了雙電層結構。當膠體相對靜止時,整個溶液呈電中性。但在外電場作用下,膠體中的膠粒和分散節制反向相對移動,就會產生電位差,此電位差稱為ξ電勢。ξ電勢是表征膠粒特性的重要物理量之一,在研究膠體及實際應用中有著重要的作用。ξ電勢和膠體的穩定性有密切關系。|ξ|值越大,表明膠粒荷電越多,膠粒之間的斥力越大,膠體越穩定。反之,則不穩定。當ξ電勢等于零時,膠體的穩定性**差,此時可觀察到聚沉的現象。因此無論制備或破壞膠體,均需要了解所研究膠體的ξ電勢。
在外加電場的作用下,荷電膠粒與分散介質間會發生相對運動,膠粒向正極或負極(視膠粒所帶電荷為負或正電而定)移動的現象,稱為電泳。電泳速度與?電勢有如下關系:
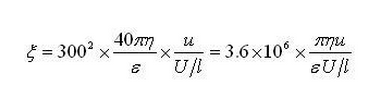
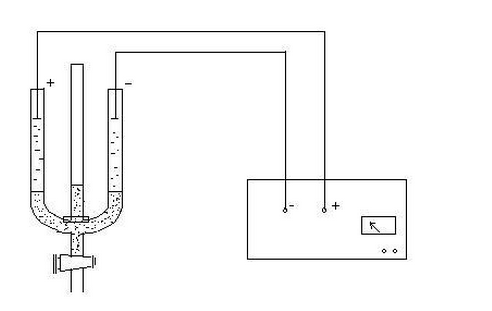
本實驗是采用宏觀電泳法來測定ζ電勢。宏觀法是觀測膠體溶液與另一個不含膠粒的無色導電溶液的界面在電場中的運動速度。對高度分散的溶膠(如Fe(OH)3溶膠和As2S3溶膠)或過濃的溶膠,只能用宏觀法。測定裝置如下:
三、實驗儀器及藥品
儀器:DY—2B型
電泳儀、電泳測定管、秒表、滴管 試劑:Fe(OH)3膠體溶液、稀NaCl溶液
四、實驗步驟
1.將Fe(OH)3膠體溶液注入預先洗凈、烘干的電泳測定管的U型管中,滴入適量的稀NaCl溶液,使其與膠體溶液的分界面清晰。然后把U型管垂直固定在鐵架臺上,在U型管兩端插入鉑電極
2.調節
電泳儀輸出電壓為85V,計時,待液面上升了0.5cm時,記下時間。再測定一次所需時間t,求出二次時間的平均值。
3.傾去U型管中的膠體溶液,按以上步驟,換上新的膠體溶液,改變電壓為115V,測定面上升0.5cm距離所需的時間,測定兩次,求出二次時間的平均值。
4.量出兩電極之間的距離,此值需測量5~6次,取其平均值 。
五、思考題
1.電泳速度的快慢與哪些因素有關?
答:(1)外加電場強度影響大,外加電壓大,速度快; (2) 與膠體凈化后所測電導值有關,電導大,電泳速度快; (3) 與兩極間距離有關,距離短,速度快;
(4) 與溫度有關,溫度高,介質的粘度降低,有利于電泳速度的提高; (5)與膠體的z 本性相關; (6)與輔助液的性質相關。
2.實驗中所用的電導液的電導為什么須與待測溶膠的電導十分相近?
答:目的是使溶液中的電勢梯度處處相等,則電泳速度一致,保證膠體移動的界面清晰。
3.要準確測定膠體電泳速度必須注意哪些問題?
答:電壓要足夠,穩定;電路暢通;溶液保證暢通無氣泡;電泳管要洗干凈,不能有雜質或其它電解質存在;溶膠要充分滲析;實驗中產生的氣泡要少;要精確測量界面上升的距離和所需的時間等。
4.在Fe(OH)3溶膠的電泳實驗中,界面如何移動,為什么?實際哪部分在移動? 答:Fe(OH)3膠體界面向負極移動,說明Fe(OH)3膠體荷正電。
5.電泳實驗可測量膠體的什么電位?其意義是什么?
答:測定一些其它溶膠的z 電位和研究電解質濃度對溶膠z 電位的影響,測定溶膠的等電點等。
六、數據處理 1.計算電泳的速度
u1=l/t=0.5cm/585s=8.547*10-4cm/s u2=l/t=0.5cm/395s=1.2658*10-3cm/s
膠體種類:Fe(OH)3膠體 η:0.8513*10-3Pa·s ε:77.2 85V
極間距
/cm
21.5
21.2
21.3
21.4
2
1.3
平均值:21.34
115V
極間距
/cm 21.4
21.3
21.5
21.2
21.3
平均值:21.34
電壓/V
電泳時間/s
兩極間距
/cm
負極移動距離/cm
電泳速度cm/s
85
585
21.34 0.5
8.547*10-4
115
395
21.34
0.5 #p#分頁標題#e#
1.2658*10-3
2.計算ξ電勢
ξ85V=40∏ηul/εU·3002=3002*40*3.14*0.8513*10-3*8.547*10-4*21.34/77.2*85=0.0267V
ξ115V=40∏ηul/εU·3002=3002*40*3.14*0.8513*10-3*1.2658*10-3*21.34/77.2*115=0.0293V
3.根據膠體的移動方向,可以看出Fe(OH)3膠體帶正電荷