SDS 平板膠片鑄造︰
1) 整理出兩組玻璃片及白板鑄膠組合,先用酒精拭凈,并選擇合適的間隔條(0.75 mm) 組合起來。請熟悉鑄膠三明治組合的正確組裝方式,以免灌入的膠液漏出來。
2) 三明治組合后直立站好,準備所要濃度的SDS 膠體溶液如表4.2. 兩片0.75mm 厚的平板膠片約需10 mL 分離膠體溶液,以及5 mL 焦集膠體溶液。APS液到**后才加入,未加APS 以前可在真空中抽去溶液中的氣體。
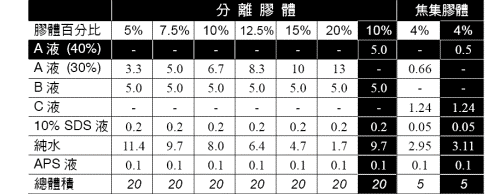
配制兩片0.75 mm 膠片所需膠體 (mL)
3) 以上分離膠體各成份在小燒杯中混合均勻后,可直接沿著玻璃一側倒入鑄膠組合到預定高度 (約八成高),勿陷住氣泡;再輕輕加上一層isopropanol. 也可使用滴管慢慢加入膠體,同樣勿注入氣泡。
4) 約30 min 可凝結,以濾紙吸去isopropanol,同法倒入焦集膠體溶液,要加到滿;盡快插入樣品槽齒模,注意不可有氣泡陷在膠體中。一般在凝膠完成后,膠體與所加的水層的間,會出現清楚的直線界面,但因為背景為白色,較不易觀察的。
5) 再度凝結后取下齒模即可使用。若不立刻使用,則把整個膠片組合用保鮮膜包好,膠面上方加一水層,勿使干掉,在4℃約可放1~2 周。
電泳方法︰
6) 若膠片組合保存于4℃,則要等待膠片完全回復室溫,才架到電泳槽。膠片一定要完全回溫,否則在進行電泳時,玻璃會因熱脹而破裂。
7) 取F液稀釋成一倍溶液,并加SDS成為0.1%;先倒入下方的正極槽,注意不可有氣泡黏在膠體,然后倒入上方的負極槽。用微量針筒或微量移液器一個一個清洗樣本槽,除去殘留在槽內的膠體 (刷牙)。刷牙的動作很重要,而且要徹底,否則注入樣本時,會有大麻煩。又因為白色氧化鋁板乃白色背景,不容易看出樣本槽的位置,可用Hoefer 所附的透明樣本槽位置模板,作為指引,順便可練習樣本添加的動作。
8) 取蛋白質樣本溶液,加入同體積E 液,以及適量追蹤染料bromophenol blue,混勻后在100℃加熱10 min.放冷短暫離心后即可依次以微量移液器注入樣本槽,樣本體積可自斟酌,但要記好位置及體積;通常都使用5~15uL.注入樣本時,盡量把針頭或吸管伸到樣本槽底部,但不要觸到樣本槽底的膠面,則可以使得樣本所占的體積**小,分離效果較好。
9) 裝上電源蓋,以100~150 V進行電泳,**高可加**200 V,視實驗的緊急程度,以及膠片發熱的情形而定。通電后兩極附近會立刻產生無數細微氣泡,是通電的特征。
10) 追蹤染料很快進入膠體,開始焦集成藍色細線,并向下泳動,大約1 h 可泳動到底邊,中止電泳,除去電源蓋。有些分子量較大的樣本,或使用濃度較高的膠片,可以等到藍色細線泳出膠體才停止。
膠片染色法:
11) 取出膠片組合,使玻璃板向上,先除去兩側間隔條,再以扁形藥匙輕輕撬起玻璃,膠片則留在白板上。切除焦集膠體,并在分離膠片的右上方截角做記號 (區別膠片的左右)。
12) 取染色盤 (大約比膠片稍大),倒入CBR染色液,在染色盤上方把上述白板倒翻過來,挑起膠片一角,利用重力使膠片掉落到染色缸中。若要進行蛋白質轉印,則膠片不能染色,要浸入轉印緩沖液中。13) 在CBR 中染色約30 min,染色盤要加密蓋,置于旋轉平臺慢速50 rpm 搖蕩的;要注意膠片是否完全沒入染色液中,否則會造成染色不均勻。14) 染色后小心把CBR 染劑倒回原來瓶中,整塊膠片變成藍色,先用自來水洗掉殘余的染色液,再倒入約20 mL 脫色液,加密蓋后再放回旋轉平臺搖蕩。染色脫色過程請戴手套,否則會在膠片上留下指紋。15) 膠片的藍色背景漸漸脫掉,待脫色液轉成藍色后,可以換新脫色液;如此脫色數次,在一小時內應可看到蛋白質的藍色色帶出現。用過的脫色液,請回收倒在有機溶液的廢液桶中。16) 待膠片背景完全透明后,染色脫色完成。倒去脫色液,改用50%甲醇液洗一兩次,待膠片縮**大約原來的尺寸,則可準備干燥的。膠片干燥法:17) 把玻璃紙cellophane 先用水浸濕,平鋪在干燥用的玻璃片上,玻璃紙會比玻璃片大,因此四周有多出來的部份。18) 把膠片平鋪在玻璃紙中央,膠片與玻璃紙間不要有任何氣泡。 除了氣泡的外,若膠片沒有回復原來的大小,或者膠片的四邊有傷痕,都很容易造成膠片干燥后的龜裂現象。19) 在膠片上再加一層浸濕的玻璃紙,也不要陷有氣泡在內;把玻璃紙多出來的部份反折到玻璃背面,用手抹平表面水份,并用紙巾吸干。20) 把此干片三明治組合放在桌上,次日即可得到已經干燥好的膠片,用電風扇或冷氣機吹的,可以加快干片速度。 干片后用指甲尖輕敲膠片,若還可以看到指甲所留下的痕跡,表示膠片并未完全干燥,要再等候。21) 待膠片完全干燥后,以美工刀或剪刀去除多余的玻璃紙,再加以護貝,則可**保存的。免疫染色的轉印紙,也可以護貝保存。